یونها، واحدهای سازنده ترکیبات شیمیایی هستند که در طبیعت و صنعت کاربرد گستردهای دارند. در میان آنها، یونهای اکسیآنیونی مثل نیترات، فسفات و سیلیکات، به دلیل نقش کلیدیشان در ساختار مواد معدنی و فرآیندهای زمینشناسی، توجه بسیاری را به خود جلب کردهاند. سیلیکاتها گروهی از ترکیبات هستند که عنصر سیلیسیم در آنها با اکسیژن پیوند برقرار کرده است. این ترکیبات بخش اصلی پوسته زمین را تشکیل میدهند و در سنگها، خاکها و حتی برخی زیستمولکولها یافت میشوند. در واقع، بیشتر سنگهای آذرین و رسوبی حاوی سیلیکات هستند و همین ترکیبات هستند که باعث تنوع و پیچیدگی ساختارهای زمینشناسی شدهاند. از نظر علمی، شناخت یون سیلیکات برای درک بهتر ترکیبات معدنی، رفتار سنگها در برابر فشار و حرارت و نیز نحوه تشکیل ذخایر معدنی بسیار مهم است. افزون بر آن، کاربردهای متعددی نیز در صنعت شیشهسازی، سرامیک، الکترونیک و حتی تصفیه آب دارد. در این مقاله تلاش میکنیم تا با زبانی ساده و دقیق به معرفی یون SiO₄، ساختار آن، نحوه تشکیل، ویژگیها و کاربردهای آن بپردازیم تا درک بهتر و جامعی از این یون مهم و پرکاربرد به دست آوریم.
آشنایی با یون سیلیکات SiO₄ و ساختار آن
یون سیلیکات با فرمول شیمیایی SiO₄⁴⁻ یکی از اصلیترین واحدهای ساختاری ترکیبات سیلیکاته به شمار میرود. این یون شامل یک اتم سیلیسیم در مرکز و چهار اتم اکسیژن در اطراف آن است که بهصورت چهاروجهی (تتراهدرال) سازمان یافتهاند. ساختار چهاروجهی SiO₄ بهعنوان سنگبنای اصلی بسیاری از مواد معدنی سیلیکاتی در نظر گرفته میشود. این یون در حالت خالص، بار منفی چهار دارد که در طبیعت با ترکیب با فلزاتی مانند آلومینیوم، آهن، کلسیم یا سدیم به ساختارهای پایدارتر تبدیل میشود.در بسیاری از ترکیبات سیلیکاتی، این یونها ممکن است بهصورت جداگانه یا متصل به یکدیگر (از طریق بهاشتراکگذاری اتمهای اکسیژن) دیده شوند. این اتصالها میتوانند زنجیرهای، لایهای یا سهبعدی باشند که باعث ایجاد ساختارهای متنوع و پیچیده در مواد معدنی میشود. یون سیلیکات به دلیل پیوندهای قوی بین سیلیسیم و اکسیژن، پایداری حرارتی و شیمیایی بالایی دارد که آن را برای کاربردهای صنعتی بسیار ارزشمند کرده است. ساختار هندسی منظم این یون، کلید فهم بسیاری از خواص فیزیکی مواد معدنی مانند سختی، نقطه ذوب و انحلالپذیری آنهاست. در ادامه مقاله با انواع دیگر این یون و نحوه تشکیل آن در طبیعت بیشتر آشنا خواهیم شد.
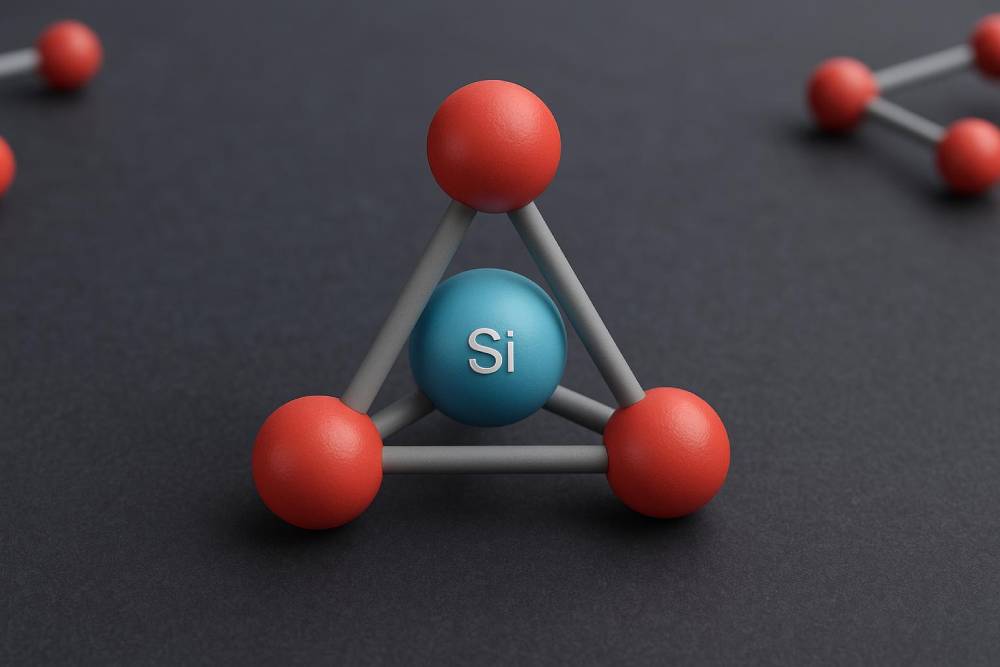
انواع مختلف یونهای سیلیکاتی و تفاوت آنها
یونهای سیلیکاتی بسته به نحوه پیوند چهاروجهیهای SiO₄ به یکدیگر، به انواع مختلفی تقسیم میشوند که هر کدام ویژگیها و کاربردهای خاص خود را دارند. سادهترین نوع، سیلیکاتهای منفرد (نزو سیلیکاتها) هستند که در آنها هر یون SiO₄⁴⁻ بهصورت مستقل وجود دارد. مثالی از این نوع، الیوین است که در سنگهای آذرین یافت میشود. نوع بعدی، سیلیکاتهای زنجیرهای یا اینوسلیکاتها هستند. این یونها میتوانند بهصورت زنجیرههای ساده (پیرواکسن) یا دوگانه (آمفیبول) ظاهر شوند که با اشتراکگذاری اتمهای اکسیژن، زنجیرههایی از چهاروجهیها را شکل میدهند. در سیلیکاتهای حلقوی یا سیکلوسلیکاتها، چهاروجهیها بهصورت دایرهای به هم متصل شدهاند. در نوع لایهای (فیلو سیلیکات)، مانند میکا و تالک، صفحات بزرگی از چهاروجهیها شکل میگیرند که خاصیت ورقهورقهشدن را ایجاد میکنند. در نهایت، سیلیکاتهای سهبعدی یا تکتوسیلیکاتها، مانند کوارتز، ساختاری شبکهای دارند که در آن هر چهاروجهی با چهار چهاروجهی دیگر اشتراک دارد. این ساختار باعث ایجاد خواص فیزیکی بسیار قوی مانند سختی بالا و مقاومت در برابر حرارت میشود. در کل، تنوع ساختاری یونهای سیلیکات، آنها را به یکی از پیچیدهترین و پرکاربردترین گروههای معدنی تبدیل کرده است.
نحوه تشکیل یون SiO₄ در طبیعت
یون SiO₄⁴⁻ عمدتاً در فرآیندهای زمینشناسی و ماگمایی شکل میگیرد. زمانی که ماگما در اعماق زمین به آرامی سرد میشود، اتمهای سیلیسیم و اکسیژن بهتدریج با یکدیگر ترکیب شده و ساختارهای چهاروجهی SiO₄ را تشکیل میدهند. این ساختارها سپس با عناصر دیگری مانند آلومینیوم، آهن، منیزیم یا سدیم واکنش داده و انواع کانیهای سیلیکاتی را ایجاد میکنند. در محیطهای رسوبی نیز، فرآیندهای شیمیایی موجب آزاد شدن یونهای سیلیکات از سنگهای آذرین و انتقال آنها به آبهای زیرزمینی یا سطحی میشود. این یونها میتوانند در واکنش با سایر مواد، دوباره به شکل رسوبات سیلیکاتی تهنشین شوند. همچنین، فعالیتهای آتشفشانی یکی دیگر از منابع مهم تولید یونهای سیلیکات است. خروج گازهای حاوی سیلیسیم از دهانه آتشفشانها و برخورد آن با اکسیژن موجود در هوا، باعث تشکیل ذرات ریز سیلیکاتی میشود که در جو پراکنده میگردند. در برخی شرایط خاص، حتی موجودات زنده مانند دیاتومها (جلبکهای میکروسکوپی) میتوانند در پوسته خود از ترکیبات سیلیکاتی استفاده کنند که در فرآیندهای زیستی نقش دارند. در مجموع، یون SiO₄ در چرخههای طبیعی زمین حضور فعال دارد و نقش مهمی در تکامل سنگها و خاکها ایفا میکند.
ویژگیهای شیمیایی و فیزیکی یون سیلیکات
یون سیلیکات دارای ویژگیهای شیمیایی و فیزیکی منحصربهفردی است که آن را در بسیاری از صنایع و فرآیندهای طبیعی کاربردی کرده است. از لحاظ شیمیایی، این یون دارای بار منفی چهار است که سبب میشود تمایل زیادی به ترکیب با یونهای مثبت مانند Ca²⁺، Na⁺، Fe²⁺ و Mg²⁺ داشته باشد. این ویژگی باعث ایجاد ساختارهای پایدار و متنوعی در مواد معدنی میشود. از نظر فیزیکی، ساختار چهاروجهی سیلیکات، پایداری بالایی در برابر حرارت و فشار دارد. همین امر موجب شده است تا بسیاری از مواد معدنی سیلیکاتی در اعماق زمین نیز پایدار بمانند. سختی بالا، نقطه ذوب زیاد و مقاومت در برابر هوازدگی از دیگر ویژگیهای برجسته این یون است. در برخی ساختارهای بلوری، پیوندهای بین یونهای سیلیکات منجر به ایجاد مواد شفاف و سخت مانند کوارتز میشود که در ساخت جواهرات و تجهیزات نوری استفاده میشود. همچنین، این یونها در تشکیل ترکیبات نامحلول نقش دارند و به همین دلیل در تصفیه آب و حذف فلزات سنگین کاربرد دارند. در مجموع، این ویژگیها باعث شدهاند یون سیلیکات به یکی از کلیدیترین اجزای ساختار زمینشناسی و صنعتی تبدیل شود که در ادامه مقاله به کاربردهای گسترده آن خواهیم پرداخت.

نقش یونهای سیلیکات در زمینشناسی و سنگها
یونهای سیلیکات، اساس ساختار بسیاری از سنگهای زمین هستند. بیش از ۹۰ درصد از مواد تشکیلدهنده پوسته زمین، از سیلیکاتها ساخته شدهاند. این یونها در انواع سنگهای آذرین، دگرگونی و رسوبی حضور دارند و ویژگیهای فیزیکی و شیمیایی سنگها را تعیین میکنند. در سنگهای آذرین مانند گرانیت یا بازالت، یونهای سیلیکات با عناصر دیگری ترکیب شده و کانیهایی مانند الیوین، پیروکسن و فلدسپات را شکل میدهند. هر یک از این کانیها، با ترکیب خاص خود، در دمای مشخصی از ماگما بلورین میشوند. در نتیجه، نوع و میزان سیلیکات موجود در یک سنگ، اطلاعات ارزشمندی درباره تاریخچه زمینشناسی آن به ما میدهد. در فرآیندهای دگرگونی، سنگهایی که در معرض حرارت و فشار زیاد قرار میگیرند، ترکیبات سیلیکاتی جدیدی را ایجاد میکنند که میتوانند نشانگر شرایط محیطی زمین در اعماق مختلف باشند. همچنین در سنگهای رسوبی، سیلیکاتها از فرسایش و تجزیه سنگهای آذرین بهوجود میآیند و به شکل ماسهسنگها یا رسیها رسوب میکنند. نقش یون سیلیکات در زمینشناسی فراتر از حضور فیزیکی در سنگهاست؛ این یون در چرخههای ژئوشیمیایی، ایجاد ذخایر معدنی و حتی در پیشبینی زلزلهها نیز نقش دارد. یکی از مهمترین کانیهای مرتبط با این یون، سنگ سیلیس است که در بسیاری از صنایع نیز کاربرد گسترده دارد.
کاربردهای صنعتی یون SiO₄ و مشتقات آن
یون سیلیکات، با توجه به ساختار پایدار و واکنشپذیری خاص خود، در طیف وسیعی از صنایع استفاده میشود. یکی از شناختهشدهترین کاربردهای آن در صنعت شیشهسازی است. ترکیب یونهای سیلیکات با سدیم و کلسیم، ماده اولیه شیشههای معمولی را تشکیل میدهد که در بطریها، پنجرهها و صفحات نمایش استفاده میشود. در صنعت سرامیک، سیلیکاتها بهعنوان مواد اولیه در تهیه لعابها و بدنه ظروف چینی به کار میروند. در ساخت سیمان نیز، یونهای سیلیکاتی موجود در آهک و خاک رس، هنگام پخت، ساختارهایی ایجاد میکنند که خاصیت چسبندگی سیمان را تضمین میکند. یکی دیگر از کاربردهای مهم، استفاده از سیلیکات سدیم بهعنوان چسب، ماده نسوز، یا حتی پاککننده صنعتی است. این ماده بهدلیل خاصیت قلیایی و ساختار پیچیدهاش، توانایی حل چربیها و تثبیت رنگ را دارد. در صنعت کاغذسازی، سیلیکاتها در تثبیت جوهر و افزایش کیفیت کاغذ نقش دارند. همچنین در فناوری نانو و الکترونیک، برخی از مشتقات سیلیکاتی برای ساخت نیمههادیها، فیبرهای نوری و تجهیزات پیشرفته مورد استفاده قرار میگیرند. در نهایت، در تصفیه آب نیز یونهای سیلیکات با جذب فلزات سنگین و آلایندهها، به پاکسازی منابع آبی کمک میکنند. همه این موارد نشان میدهد که یون SiO₄ یکی از عناصر کلیدی در صنعت مدرن است.
نقش یون سیلیکات در زیستمحیط و منابع آبی
یون سیلیکات نقشی مهم در حفظ تعادل شیمیایی آبهای سطحی و زیرزمینی دارد. این یون در اثر فرسایش سنگهای سیلیکاتی، وارد رودخانهها، دریاچهها و اقیانوسها میشود. یکی از نقشهای زیستمحیطی کلیدی آن، تأمین عنصر سیلیسیم برای جلبکهای میکروسکوپی بهنام دیاتومها است. این جلبکها پوستههایی از جنس سیلیکات دارند و نقش مهمی در زنجیره غذایی دریایی ایفا میکنند. افزون بر آن، یونهای سیلیکات میتوانند با فلزات سنگین مانند سرب، جیوه یا کادمیوم ترکیب شوند و آنها را به صورت نامحلول درآورند، که از ورود این فلزات به بدن موجودات زنده جلوگیری میکند. از این ویژگی در تصفیه فاضلابها و آبهای صنعتی نیز بهرهبرداری میشود. در برخی منابع آبی، وجود بیش از حد یون سیلیکات میتواند باعث رسوبگذاری در لولهها و تجهیزات شود، به همین دلیل کنترل میزان آن در آبهای صنعتی اهمیت زیادی دارد. از دیدگاه محیطزیستی، سیلیکاتها جزو ترکیباتی محسوب میشوند که زیستسازگارند و به طبیعت آسیب نمیزنند. برخلاف برخی ترکیبات شیمیایی مصنوعی، یون سیلیکات نهتنها سمی نیست، بلکه در فرآیندهای زیستی نیز شرکت میکند. این ویژگی، آن را به گزینهای مناسب برای استفاده در محصولات پاککننده، کودهای کشاورزی و مواد زیستپایه تبدیل کرده است.
مقایسه یون سیلیکات با سایر یونهای اکسیآنیونی
یون سیلیکات در میان یونهای اکسیآنیونی، ویژگیهای ساختاری و عملکردی منحصربهفردی دارد. برای مثال، در مقایسه با یون فسفات (PO₄³⁻)، سیلیکات بار منفی بیشتری دارد (⁴⁻ در مقابل ³⁻) و ساختار چهاروجهی مشابهی دارد، اما از نظر پایداری حرارتی و مقاومت در برابر هیدرولیز، سیلیکات برتری دارد. در مقایسه با یون نیترات (NO₃⁻)، که ساختاری مسطح و بار الکتریکی کمتر دارد، سیلیکات از نظر ساختاری بسیار پیچیدهتر و متنوعتر است. نیترات بهراحتی در آب حل میشود، درحالیکه بسیاری از ترکیبات سیلیکاتی بهسختی محلول هستند و این ویژگی در کاربردهای خاص مثل تصفیه آب یا ساخت مواد نسوز اهمیت دارد. همچنین، یون سولفات (SO₄²⁻) از نظر ساختار شباهتهایی با سیلیکات دارد، اما پیوندهای بین گوگرد و اکسیژن نسبت به پیوندهای سیلیسیم-اکسیژن، کمتر مقاوم هستند. به همین دلیل، سیلیکاتها در ساختارهای بلوری سنگها بیشتر دوام میآورند. در صنعت، ترکیبات حاوی فسفات یا سولفات معمولاً در شویندهها و کودها استفاده میشوند، اما بهدلیل تأثیرات زیستمحیطی منفی، استفاده از آنها محدود شده است. در مقابل، سیلیکاتها بهعنوان جایگزینی سبز و پایدار برای این ترکیبات پیشنهاد میشوند. در مجموع، یون سیلیکات با ترکیب پیچیده، دوام بالا و زیستسازگاری بهتر، جایگاه ویژهای در میان یونهای اکسیآنیونی دارد.
آیا یون SiO₄ خطرناک است؟ بررسی ایمنی و زیستسازگاری
برخلاف بسیاری از یونهای صنعتی، یون سیلیکات بهعنوان یک ترکیب بیخطر برای انسان و محیط زیست شناخته میشود. این یون در بسیاری از مواد طبیعی مانند خاک، سنگ و حتی آب آشامیدنی حضور دارد. به همین دلیل، بدن انسان تا حدودی با آن آشناست و میتواند با غلظتهای پایین آن کنار بیاید. در صنایع مختلف، سیلیکاتها بهعنوان جایگزین ایمن برای مواد شیمیایی مضر استفاده میشوند. برای مثال، در پاککنندهها بهجای فسفاتها که موجب آلودگی محیطهای آبی میشوند، از سیلیکات استفاده میشود. در محیط کار، استفاده از ترکیبات سیلیکاتی بهصورت پودر ممکن است خطراتی مانند تحریک تنفسی ایجاد کند، اما این تنها در صورتی اتفاق میافتد که ذرات ریز آن بهصورت مزمن و در غلظت بالا استنشاق شود. استفاده از ماسک و تهویه مناسب در کارخانهها، این خطر را به حداقل میرساند. در مقایسه با بسیاری از ترکیبات شیمیایی دیگر، سیلیکاتها پایداری شیمیایی بیشتری دارند و واکنشهای خطرناک کمتری ایجاد میکنند. همچنین در طبیعت نیز قابلیت تجزیه و بازگشت به چرخه زمین را دارند. در نتیجه، میتوان گفت که یون SiO₄ نهتنها بیخطر است، بلکه بهدلیل سازگاری بالا با محیط زیست، یکی از ترکیبات ایمن و مفید در صنعت و طبیعت محسوب میشود. واژه سیلیس نیز گاه برای اشاره به ترکیبات مشابه این یون استفاده میشود.

نتیجهگیری: چرا شناخت یون سیلیکات اهمیت دارد؟
یون سیلیکات SiO₄⁴⁻ با ساختار چهاروجهی منظم، یکی از بنیادیترین اجزای تشکیلدهنده زمین و بسیاری از مواد صنعتی است. از کاربرد در سنگهای طبیعی و فرآیندهای زمینشناسی گرفته تا حضور در محصولات مصرفی روزمره مانند شیشه، سرامیک، شویندهها و حتی تصفیه آب، این یون نقش بسیار پررنگی دارد. درک ساختار، ویژگیها و واکنشپذیری یون سیلیکات به ما کمک میکند تا بهتر بتوانیم خواص فیزیکی و شیمیایی مواد را تحلیل کنیم، منابع طبیعی را مدیریت کنیم و مواد صنعتی پایدارتر و ایمنتری تولید نماییم. همچنین شناخت تفاوتهای این یون با سایر اکسیآنیونها مانند فسفات و سولفات، اهمیت آن را در انتخاب ترکیبات جایگزین و سازگار با محیط زیست برجسته میکند. در دوران کنونی که توسعه پایدار و حفاظت از منابع طبیعی از اهمیت بالایی برخوردار است، استفاده از ترکیباتی مانند سیلیکاتها که کمخطر، مقاوم و فراوان هستند، میتواند راهگشای بسیاری از چالشهای زیستمحیطی و صنعتی باشد. یون SiO₄ نهتنها پلی میان شیمی و زمینشناسی است، بلکه پلی بهسوی آیندهای ایمنتر و پایدارتر در فناوری و زندگی روزمره ما نیز هست.





بدون دیدگاه